ElendiLabs
虽然进口商有义务记录并向 LRP 报告质量问题,但根据 COP-01 守则,LRP 是法定的唯一沟通窗口。在发生严重事故(AE)或召回(FSCA)时,LRP 必须在 10 天内向 MDD 提交报告。 • 沟通路径: 列名进口商不能越过 LRP 直接处理行政程序。这种“独立 LRP + 商业进口商”的模式在 2026 年最为推荐,因为它能防止您的列名资格因更换经销商而失效,同时也确保了监管合规的专业性。
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
3 de maio de 2025
Aproximadamente 5 minutos
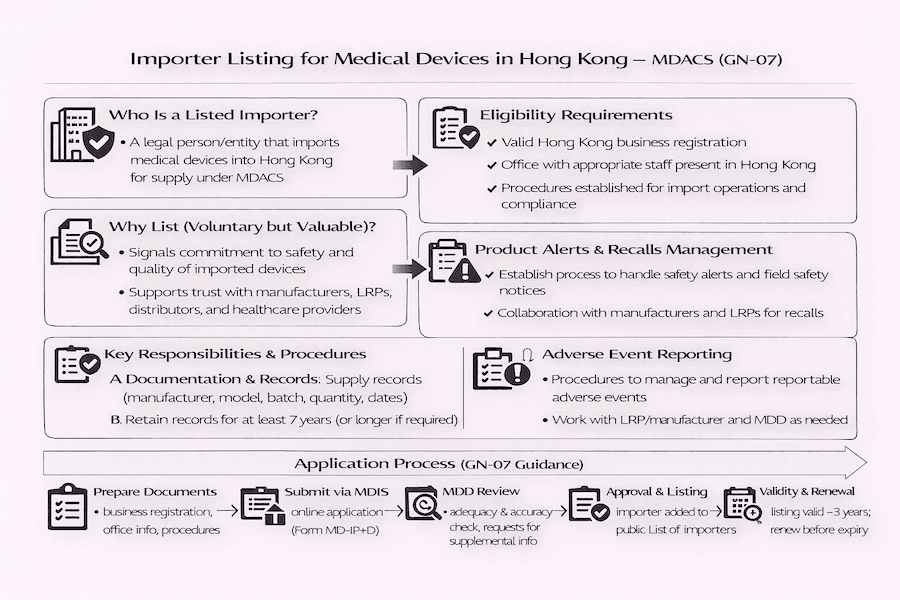
De nossa perspectiva, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong não se trata apenas de listar os dispositivos médicos em si; ele também monitora de perto todos os participantes da cadeia de suprimentos. Para as empresas que trazem dispositivos médicos para Hong Kong, as "Notas de Orientação para Listagem de Importadores de Dispositivos Médicos" (GN-07) delineiam claramente os passos e requisitos para se listar voluntariamente sob este sistema. Embora não seja obrigatório no momento, optar por ser listado, em nossa experiência, demonstra um forte compromisso com a qualidade e o cumprimento das regras no mercado de dispositivos médicos de Hong Kong. É um passo fundamental para qualquer importador de dispositivos médicos em Hong Kong.
Quando falamos sobre "dispositivos médicos" em Hong Kong, o que exatamente a Divisão de Dispositivos Médicos (MDD) do Departamento de Saúde considera como tal? De acordo com suas diretrizes, um dispositivo médico é essencialmente qualquer instrumento, aparelho, máquina, equipamento, implante, software, material ou item similar. É importante que o fabricante tenha a intenção de que ele seja usado, seja sozinho ou com outros itens, para fins médicos específicos em humanos.
Esses fins incluem:
Crucialmente, um dispositivo médico não alcança seu efeito principal no corpo através de medicamentos, respostas imunes ou metabolismo. No entanto, ele pode ser auxiliado em sua função por tais meios. Portanto, é bastante abrangente, cobrindo tudo, desde um simples curativo até softwares de diagnóstico complexos!
Então, o que é um "Importador" no mundo do MDACS, especificamente para dispositivos médicos? De maneira geral, um "Importador" é uma empresa ou organização (uma "entidade legal") que traz, ou organiza a entrada, de quaisquer dispositivos médicos cobertos pelo MDACS em Hong Kong para venda ou fornecimento aqui. De nossa compreensão, essa definição geralmente não inclui indivíduos que simplesmente importam dispositivos para uso pessoal. Essa distinção é vital para a regulação de dispositivos médicos em Hong Kong.
Qualquer empresa legal com um escritório devidamente estruturado em Hong Kong que lida com a importação de dispositivos médicos pode se inscrever para ser incluída na "Lista de Importadores." De acordo com nossa experiência, a listagem voluntária de importadores oferece várias vantagens claras:
Para ser listado sob o MDACS, um importador precisa estabelecer, seguir e manter um conjunto de procedimentos escritos. Qual é a visão geral aqui? Esses procedimentos são absolutamente vitais para controlar e gerenciar adequadamente os dispositivos médicos importados, garantindo sua segurança e qualidade desde a chegada até a distribuição. Eles devem cobrir áreas importantes como:
Pronto para se inscrever? O processo para ser listado como importador de dispositivos médicos em Hong Kong geralmente envolve estas etapas, com base em nossa orientação aos clientes:
Ser listado como importador de dispositivos médicos não é um evento único; é um compromisso contínuo. De acordo com nossa experiência, espera-se que os importadores listados mantenham continuamente seus procedimentos escritos em vigor e os sigam, mantenham seus registros atualizados e informem rapidamente à MDD sobre quaisquer mudanças ou incidentes importantes. Essa dedicação contínua é realmente importante para manter a cadeia de suprimentos de dispositivos médicos confiável e garantir a proteção da saúde pública aqui em Hong Kong. Trata-se de manter a confiança e a segurança no mercado de saúde de Hong Kong a longo prazo.
Entraremos em contato pessoalmente.
ElendiLabs
虽然进口商有义务记录并向 LRP 报告质量问题,但根据 COP-01 守则,LRP 是法定的唯一沟通窗口。在发生严重事故(AE)或召回(FSCA)时,LRP 必须在 10 天内向 MDD 提交报告。 • 沟通路径: 列名进口商不能越过 LRP 直接处理行政程序。这种“独立 LRP + 商业进口商”的模式在 2026 年最为推荐,因为它能防止您的列名资格因更换经销商而失效,同时也确保了监管合规的专业性。
Anonymous
我们在香港有三家不同的经销商,分别负责公立医院、私立诊所和零售药店。根据 GN-07 指南,我们可以将这三家全部登记为‘列名进口商’吗?如果其中一家进口商因为违反《医疗器械实务守则》(Code of Practice) 被除名,是否会连带影响我们的产品表列号 (HKMD No.) 或其他两家进口商的进口资格?
ElendiLabs
您可以授权无限数量的列名进口商。通过 LRP 在 MDIS (医疗器械信息系统) 门户操作,只需提交每家进口商的商业登记证 (BR) 及对应的授权书。 连带影响: 2026 年的监管趋于精准化。单个进口商的违规(如仓储温控不达标)通常只会导致该特定进口商从您的产品表列名单中移除,不会自动撤销产品的 HKMD 编号。但是,如果违规涉及系统性质量问题(如篡改标签),MDD 可能会要求 LRP 解释,严重时会暂停整个产品的进口。
Anonymous
我们目前的进口商仅具备基础的商业登记。面对即将立法的 CMPR 框架,进口商是否必须获得 ISO 13485 认证?
ElendiLabs
目前 MDACS 仅要求进口商遵循“Code of Practice”。但 2026 年 CMPR 预览版建议,处理 Class III/IV 高风险设备的进口商需建立符合 ISO 13485 (或同等标准) 的质量管理体系。
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Aproximadamente 5 minutos
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.
Aproximadamente 5 minutos
Este artigo detalha o processo de aplicação para listar Dispositivos Médicos de Diagnóstico In Vitro de Classe B, C e D (IVDMDs) sob o Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), conforme orientado pelo GN-06. Ele abrange classificação, elegibilidade, requisitos de submissão e a aplicação online via MDIS, tudo baseado em nossos insights e experiência para uma listagem eficiente de IVDMD em Hong Kong.
Anonymous
我们计划聘请 ElendiLabs 作为独立 LRP 以掌握产品所有权,但我们的商业合作伙伴希望作为列名进口商。在2026年的合规要求下,如果发生产品召回,由谁负责向卫生署医疗器械分部 (MDD) 提交初步报告?进口商是否可以直接与 MDD 沟通,还是必须通过我们的 LRP?