Precisa de Ajuda Regulatória? Experimente Nossa Plataforma
Publique suas perguntas regulatórias ou solicite orçamentos de consultores farmacêuticos verificados em todo o mundo. Conecte-se com especialistas do seu mercado.
24 de maio de 2025
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
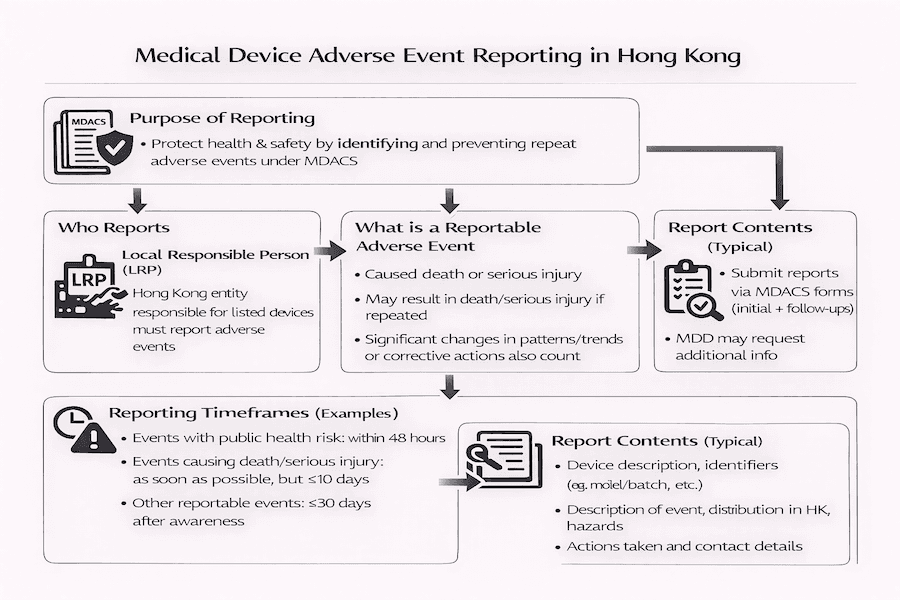
A Importância da Notificação de Eventos Adversos em Hong Kong: Nossas Perspectivas
De nossa perspectiva, o Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) em Hong Kong coloca uma grande ênfase em monitorar dispositivos médicos mesmo após sua venda. Esse processo é chamado de "vigilância pós-comercialização", e uma parte crucial dele é a notificação de eventos adversos. O principal objetivo desse sistema de notificação, conforme explicado em guias como GN-03-E, é simples: garantir que a saúde e a segurança de todos estejam melhor protegidas. Como isso é feito? Ao coletar e compartilhar informações sobre problemas que ocorrem, podemos aprender com eles e evitar que questões semelhantes com dispositivos médicos aconteçam novamente. Isso é vital para a segurança de dispositivos médicos em Hong Kong.
Embora o MDACS seja atualmente um sistema administrativo (o que significa que ainda não é uma lei rigorosa), de acordo com nossa experiência, seu forte sistema de notificação de eventos adversos garante que perigos potenciais sejam rapidamente identificados, investigados e tratados. Isso, em última análise, mantém tanto os usuários quanto os pacientes seguros.
Quem é Responsável pela Notificação? Nossa Compreensão do Papel da Pessoa Responsável Local (LRP)
Sob o MDACS, a Pessoa Responsável Local (LRP) carrega o principal ônus de relatar e gerenciar quaisquer eventos adversos que ocorram em Hong Kong envolvendo os dispositivos médicos que listaram. De nossa perspectiva, isso realmente destaca a importância da LRP – eles são o elo chave entre o fabricante, a Divisão de Dispositivos Médicos (MDD) do Departamento de Saúde e todos os outros envolvidos. Seu papel é central para a conformidade regulatória em Hong Kong.
O Que Exatamente é um Evento Adverso Notificável? Vamos Analisar.
Então, que tipo de incidente conta como um "evento adverso notificável"? Geralmente, estamos falando sobre qualquer situação envolvendo um dispositivo médico que já causou, ou poderia potencialmente causar, certos resultados graves. Embora as definições exatas estejam dispostas em guias oficiais, com base em nossa experiência, elas normalmente incluem eventos que levam a:
- A morte de um paciente, alguém usando o dispositivo ou outra pessoa.
- Lesão grave a um paciente, usuário ou outra pessoa.
- Um evento que, se ocorresse novamente, poderia ter levado à morte ou lesão grave.
Isso também abrange situações em que a LRP ou o fabricante notam uma mudança significativa na frequência ou no padrão em que um problema está ocorrendo – especialmente se isso puder levar a danos graves. Também se aplica quando eles começam a tomar ações corretivas para prevenir tais danos. Esses eventos são fundamentais para a vigilância de dispositivos médicos.
Prazos de Notificação: Por Que a Velocidade Importa
Por que é tão importante relatar esses eventos rapidamente? Porque a notificação oportuna permite investigações rápidas e ações apropriadas a serem tomadas. O MDACS estabelece prazos específicos para informar a MDD sobre esses eventos. De nossa compreensão, esses prazos geralmente mudam dependendo da gravidade do incidente:
- "Relatórios acelerados" (ou seja, muito rápidos, às vezes dentro de 2 ou 10 dias corridos) são necessários para eventos que causam morte ou lesão grave, ou aqueles que representam uma séria ameaça à saúde pública.
- "Relatórios de acompanhamento" são exigidos à medida que a investigação avança, fornecendo mais detalhes.
- "Relatórios finais" são submetidos uma vez que a investigação esteja completa, apresentando todas as descobertas e explicando quaisquer ações corretivas e preventivas (CAPA) tomadas.
O Processo de Investigação de Eventos Adversos: Nossa Experiência
Uma vez que a MDD recebe um relatório de evento adverso, ela pode solicitar que a LRP realize uma investigação muito minuciosa sobre o que aconteceu. A LRP é responsável por essa investigação, muitas vezes trabalhando em conjunto com o fabricante do dispositivo ou outras partes relevantes. O principal objetivo da investigação é descobrir por que o evento ocorreu, identificar qualquer coisa que contribuiu para isso e implementar as correções necessárias para evitar que aconteça novamente. A LRP deve então enviar um relatório detalhado de suas descobertas e recomendações à MDD. Também é importante lembrar que a MDD sempre tem o direito de conduzir sua própria investigação independente se achar necessário. Isso garante responsabilidade na regulação de dispositivos médicos em Hong Kong.
Por Que Documentação Abrangente e Vigilância Pós-Comercialização São Fundamentais
A notificação eficaz de eventos adversos, de nossa perspectiva, depende fortemente de sistemas sólidos que fabricantes e LRPs têm em vigor para monitorar dispositivos após sua liberação no mercado. O que isso envolve?
- Estabelecer procedimentos claros e escritos para identificar, avaliar e relatar eventos adversos.
- Manter registros detalhados de todas as reclamações, investigações e ações corretivas tomadas.
- Garantir que os dispositivos possam ser facilmente rastreados (rastreabilidade) para que recalls rápidos e eficazes possam ocorrer, se necessário.
De acordo com nossa experiência, manter-se informado sobre as mais recentes notas de orientação e atualizações regulatórias da MDD é absolutamente essencial para a conformidade contínua. Esse esforço contínuo contribui significativamente para a segurança e qualidade geral dos dispositivos médicos no dinâmico mercado de saúde de Hong Kong.
Pergunte Qualquer Coisa
Entraremos em contato pessoalmente.
Precisa de Orientação Especializada?
Explore Nosso Guia Interativo de Dispositivos Médicos
Obtenha orientação passo a passo sobre as regulamentações de dispositivos médicos de Hong Kong, classificação de dispositivos e requisitos de conformidade.
Ver Guia de Dispositivos MédicosEntre em contato conosco em contact@elendilabs.com / +852 4416 5550
Artigos Relacionados
Aproximadamente 5 minutos
Relato de Eventos Adversos de Dispositivos Médicos em Hong Kong: Um Guia para LRPs
A notificação de eventos adversos é um componente crítico do Sistema de Controle Administrativo de Dispositivos Médicos de Hong Kong (MDACS), com o objetivo de melhorar a saúde e a segurança pública. Este artigo descreve os requisitos e responsabilidades das Pessoas Responsáveis Locais (LRPs) na notificação de eventos adversos relacionados a dispositivos médicos listados, com base em nossas percepções.
Aproximadamente 5 minutos
Regulamentações e Registro de Dispositivos Médicos em Hong Kong
Guia completo sobre regulamentações de dispositivos médicos, classificação, requisitos de registro e vigilância pós-comercialização em Hong Kong.
Aproximadamente 5 minutos
Navegando nas Regulamentações de Dispositivos Médicos em Hong Kong: A Estrutura MDACS
O Sistema de Controle Administrativo de Dispositivos Médicos (MDACS) de Hong Kong fornece uma estrutura robusta, embora atualmente voluntária, para a regulamentação de dispositivos médicos. Este artigo explora as principais características do sistema, incluindo a classificação de dispositivos, o processo de listagem, o papel crucial das Pessoas Responsáveis Locais (LRPs) e sua importância crescente para o acesso ao mercado e a aquisição pública, tudo a partir de nossas percepções e experiências.