返回文章列表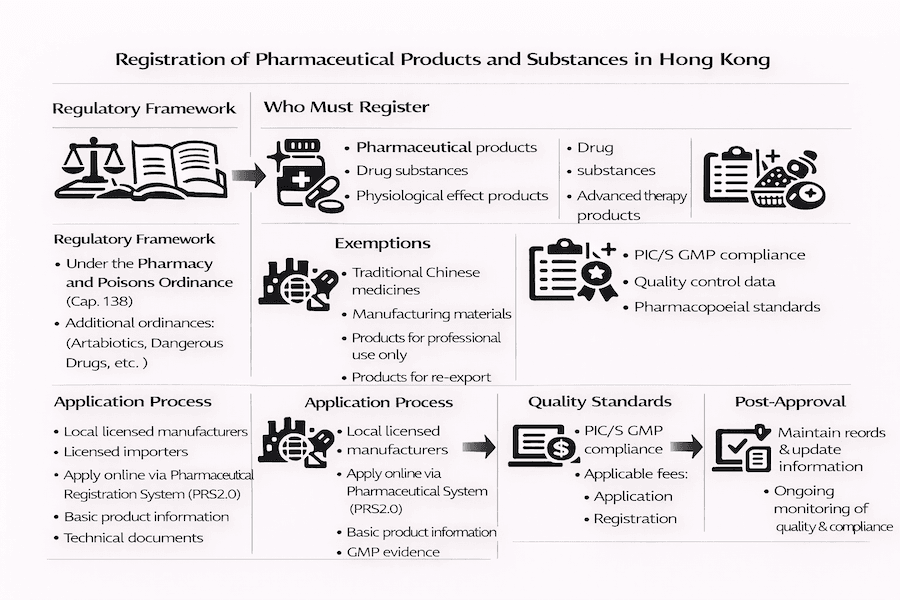
注冊
2024年7月20日
約5分鐘
專業指南:香港藥劑製品註冊

專業指南:香港藥劑製品註冊
本指南為醫療專業人員、製造商和分銷商提供有關香港藥劑製品的重要信息。
監管框架
管治法規
-
藥劑業及毒藥條例(第138章)
- 藥品主要法規
- 註冊要求和程序
- 執法條款
-
相關條例
- 抗生素條例(第137章)
- 危險藥物條例(第134章)
- 不良醫藥廣告條例(第231章)
註冊要求
需要註冊的產品
-
藥品
- 具有藥用聲稱的產品
- 含有藥物成分的產品
- 影響生理功能的產品
- 先進治療產品
-
豁免類別
- 中藥產品
- 製造材料
- 專業使用產品
- 再出口產品
- 臨床試驗產品
申請程序
資格標準
-
本地製造商
- 必須是持牌製造商
- 必須有GMP認證
- 必須符合PIC/S標準
-
進口商
- 必須是持牌批發商
- 必須有製造商授權
- 必須符合進口要求
所需文件
-
基本信息
- 商業登記證書
- 製造商授權書
- 申請授權書
-
技術文件
- GMP證書
- 自由銷售證書
- 產品規格
- 質量控制數據
-
特殊要求
- 動物來源材料文件
- 多個製造商聲明
- 生物等效性數據(如適用)
質量標準
製造要求
-
GMP合規
- PIC/S GMP標準
- 質量管理系統
- 設施要求
-
質量控制
- 放行規格
- 穩定性數據
- 驗證方案
藥典標準
- 中國藥典
- 英國藥典
- 歐洲藥典
- 國際藥典
- 日本藥典
- 美國藥典
申請提交
在線系統
- 使用PRS 2.0系統
- 提交電子文件
- 支付申請費(1,100港元)
支持文件
- 提交原始證書
- 提供認證副本
- 必要時提供翻譯
獲批後要求
註冊費
- 每產品1,370港元
- 獲批後支付
- 領取證書所需
合規義務
-
文件管理
- 維護記錄
- 更新信息
- 報告變更
-
質量保證
- 定期測試
- 穩定性監測
- 投訴處理
特殊考慮
專利權
- 管理局不考慮專利
- 申請人負責合規
- 潛在侵權風險
- 建議法律諮詢
多個製造商
- 首選單一製造途徑
- 替代途徑需要單獨申請
- 需要明確的角色文件
申請追蹤
進度監控
- 追蹤申請狀態
- 引用檔案編號
- 聯繫藥物註冊組
- 必要時跟進
重要注意事項
法律合規
- 遵循現行法規
- 監控監管更新
- 維護文件
- 確保質量標準
專業責任
- 核實產品資格
- 確保文件完整
- 監控申請進度
- 維持合規
聯繫信息
衞生署藥物辦公室
其他資源
有任何問題?
我們會親自跟進回覆您。
100% 回覆率 • 7個工作天內回覆
重要免責聲明