返回文章列表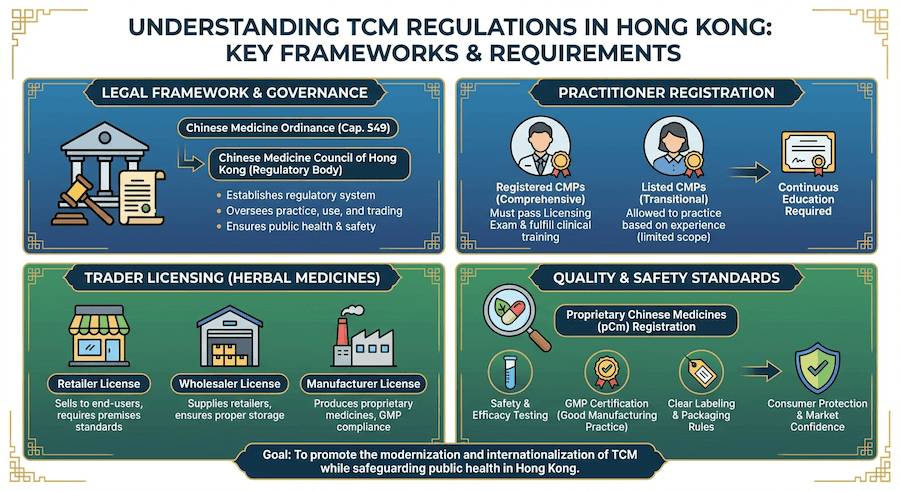
其他
2024年6月5日
約5分鐘
香港的中醫藥法規 (Traditional Chinese Medicine Regulations)

香港的中醫藥法規 (Traditional Chinese Medicine Regulations)
中醫藥在香港有著悠久的歷史,並受到全面法律框架的監管。《中醫藥條例》為中醫執業者、中藥和相關活動提供了監管結構。
法規框架
香港中醫藥管理委員會根據《中醫藥條例》(第549章) 監督中醫藥的監管。這包括執業者註冊、中藥監管和貿易活動許可。
主要監管機構:
- 香港中醫藥管理委員會 (Chinese Medicine Council of Hong Kong)
- 中醫組 (Chinese Medicine Board)
- 中藥組 (Chinese Medicines Board)
- 衛生署中醫藥事務部 (Department of Health, Chinese Medicine Division)
中醫執業者註冊
註冊類別:
- 註冊中醫師 (Registered Chinese Medicine Practitioners, CMP)
- 表列中醫師 (Listed Chinese Medicine Practitioners)
- 註冊中醫師(骨傷科)(Registered Chinese Medicine Practitioners, Bone-setting)
- 註冊中醫師(針灸科)(Registered Chinese Medicine Practitioners, Acupuncture)
註冊要求:
- 認可資格 (Recognized Qualifications)
- 臨床經驗 (Clinical Experience)
- 考試要求 (Examination Requirements)
- 持續教育 (Continuing Education)
- 專業操守標準 (Professional Conduct Standards)
中藥監管
中藥分類:
- 中成藥 (Proprietary Chinese Medicines, pCm)
- 中藥材 (Chinese Herbal Medicines)
- 中藥材料 (Chinese Medicine Materials)
註冊程序:
- 產品註冊申請 (Product Registration Application)
- 安全性和有效性評估 (Safety and Efficacy Assessment)
- 質量標準合規 (Quality Standards Compliance)
- 標籤要求 (Labeling Requirements)
- 製造標準 (Manufacturing Standards)
中成藥 (pCm)
註冊要求:
- 產品信息和成分 (Product Information and Composition)
- 製造詳情 (Manufacturing Details)
- 安全數據 (Safety Data)
- 療效證據 (Efficacy Evidence)
- 質量控制標準 (Quality Control Standards)
類別:
- 第一類:既定配方 (Established Formulations)
- 第二類:修改傳統配方 (Modified Traditional Formulations)
- 第三類:新配方 (New Formulations)
文件:
- 產品註冊表格 (Product Registration Form)
- 製造授權 (Manufacturing Authorization)
- 質量標準 (Quality Standards)
- 臨床數據(如需要)(Clinical Data if Required)
- 標籤信息 (Labeling Information)
中藥材
進口和貿易:
- 批發商牌照 (Wholesale Dealer License)
- 進口許可證要求 (Import License Requirements)
- 儲存和處理標準 (Storage and Handling Standards)
- 記錄保存義務 (Record Keeping Obligations)
- 質量保證措施 (Quality Assurance Measures)
質量標準:
- 鑑別要求 (Identification Requirements)
- 純度標準 (Purity Standards)
- 污染限度 (Contamination Limits)
- 農藥殘留限度 (Pesticide Residue Limits)
- 重金屬限度 (Heavy Metal Limits)
製造要求
良好製造規範 (GMP):
- 設施設計和建設 (Facility Design and Construction)
- 設備和公用設施 (Equipment and Utilities)
- 人員和培訓 (Personnel and Training)
- 生產控制 (Production Controls)
- 質量控制系統 (Quality Control Systems)
製造牌照:
- 申請要求 (Application Requirements)
- 設施檢查 (Facility Inspection)
- 合規評估 (Compliance Assessment)
- 牌照條件 (License Conditions)
- 續期程序 (Renewal Procedures)
貿易和分銷
批發商牌照:
- 商業註冊 (Business Registration)
- 場所要求 (Premises Requirements)
- 人員資格 (Personnel Qualifications)
- 記錄保存系統 (Record Keeping Systems)
- 儲存條件 (Storage Conditions)
零售要求:
- 表列中藥材零售商 (Listed Seller of Chinese Medicines)
- 場所標準 (Premises Standards)
- 展示要求 (Display Requirements)
- 銷售限制 (Sales Restrictions)
- 記錄保存 (Record Keeping)
質量控制和測試
測試要求:
- 鑑別測試 (Identity Testing)
- 純度分析 (Purity Analysis)
- 微生物測試 (Microbiological Testing)
- 重金屬分析 (Heavy Metal Analysis)
- 農藥殘留測試 (Pesticide Residue Testing)
實驗室標準:
- 認可測試設施 (Accredited Testing Facilities)
- 經驗證方法 (Validated Methods)
- 參考標準 (Reference Standards)
- 質量保證 (Quality Assurance)
- 文件要求 (Documentation Requirements)
標籤和廣告
標籤要求:
- 產品名稱和成分 (Product Name and Composition)
- 製造商信息 (Manufacturer Information)
- 批號和有效期 (Batch Number and Expiry Date)
- 儲存說明 (Storage Instructions)
- 使用說明 (Usage Directions)
廣告限制:
- 禁止聲稱 (Prohibited Claims)
- 治療聲稱 (Therapeutic Claims)
- 批准要求 (Approval Requirements)
- 罰則條文 (Penalty Provisions)
- 合規監察 (Compliance Monitoring)
進出口
進口要求:
- 進口許可證申請 (Import License Application)
- 產品註冊證書 (Certificate of registration)
- 海關清關 (Customs Clearance)
- 文件要求 (Documentation Requirements)
- 原產地國家 (Country of origin)
- CITES進口許可證(如適用)
出口要求:
- 出口許可證 (Export License)
- 原產地證書 (Certificate of Origin)
- CITES出口許可證(如適用)
- 目的地國家要求 (Destination Country Requirements)
- 文件合規 (Documentation Compliance)
執法和處罰
檢查權力:
- 場所檢查 (Premises Inspection)
- 樣本收集 (Sample Collection)
- 文件檢查 (Document Examination)
- 調查權力 (Investigation Authority)
- 執法行動 (Enforcement Actions)
處罰:
- 行政制裁 (Administrative Sanctions)
- 刑事檢控 (Criminal Prosecution)
- 牌照暫停 (License Suspension)
- 產品召回 (Product Recall)
- 經濟處罰 (Financial Penalties)
國際協調
WHO 指導原則:
- 質量標準 (Quality Standards)
- 安全要求 (Safety Requirements)
- 良好實踐 (Good Practices)
- 法規協調 (Regulatory Harmonization)
- 國際合作 (International Cooperation)
區域合作:
- 東盟協調 (ASEAN Harmonization)
- 相互認可 (Mutual Recognition)
- 信息共享 (Information Sharing)
- 聯合檢查 (Joint Inspections)
- 能力建設 (Capacity Building)
挑戰和機遇
常見挑戰:
- 質量標準化 (Quality Standardization)
- 安全評估 (Safety Assessment)
- 法規合規 (Regulatory Compliance)
- 國際貿易 (International Trade)
- 消費者保護 (Consumer Protection)
市場機遇:
- 全球需求增長 (Growing Global Demand)
- 配方創新 (Innovation in Formulations)
- 技術整合 (Technology Integration)
- 出口潛力 (Export Potential)
- 醫療整合 (Healthcare Integration)
技術和創新
現代方法:
- 分析技術 (Analytical Technologies)
- 質量控制自動化 (Quality Control Automation)
- 數字文檔 (Digital Documentation)
- 可追溯系統 (Traceability Systems)
- 數據管理 (Data Management)
研究和開發:
- 臨床研究 (Clinical Studies)
- 藥理研究 (Pharmacological Research)
- 質量改進 (Quality Improvement)
- 新產品開發 (New Product Development)
- 循證醫學 (Evidence-Based Medicine)
合規最佳實踐
文件管理:
- 全面記錄 (Comprehensive Records)
- 版本控制 (Version Control)
- 定期更新 (Regular Updates)
- 審計追蹤 (Audit Trails)
- 備份系統 (Backup Systems)
質量保證:
- 供應商確認 (Supplier Qualification)
- 進料檢查 (Incoming Inspection)
- 過程控制 (Process Controls)
- 最終測試 (Final Testing)
- 持續監測 (Continuous Monitoring)
員工培訓:
- 法規意識 (Regulatory Awareness)
- 技術能力 (Technical Competency)
- 質量程序 (Quality Procedures)
- 安全協議 (Safety Protocols)
- 持續教育 (Continuing Education)
未來發展
法規演變:
- 基於風險的方法 (Risk-Based Approaches)
- 國際協調 (International Harmonization)
- 數字化轉型 (Digital Transformation)
- 證據要求 (Evidence Requirements)
- 安全監測 (Safety Monitoring)
行業趨勢:
- 現代化倡議 (Modernization Initiatives)
- 質量改進 (Quality Improvements)
- 全球擴張 (Global Expansion)
- 創新支持 (Innovation Support)
- 與常規醫學整合 (Integration with Conventional Medicine)
結論
香港的中醫藥監管為確保質量、安全和療效提供了全面的框架。成功需要了解法規要求、實施健全的質量系統,並保持對不斷變化標準的合規。
如需中醫藥法規合規的專業指導,請聯絡 ElendiLabs 獲得專業諮詢。
有任何問題?
我們會親自跟進回覆您。
100% 回覆率 • 7個工作天內回覆
重要免責聲明