2025年5月24日
約5分鐘
香港醫療儀器不良事件呈報:本地負責人 (LRP) 指南
香港不良事件呈報的重要性:我們的見解
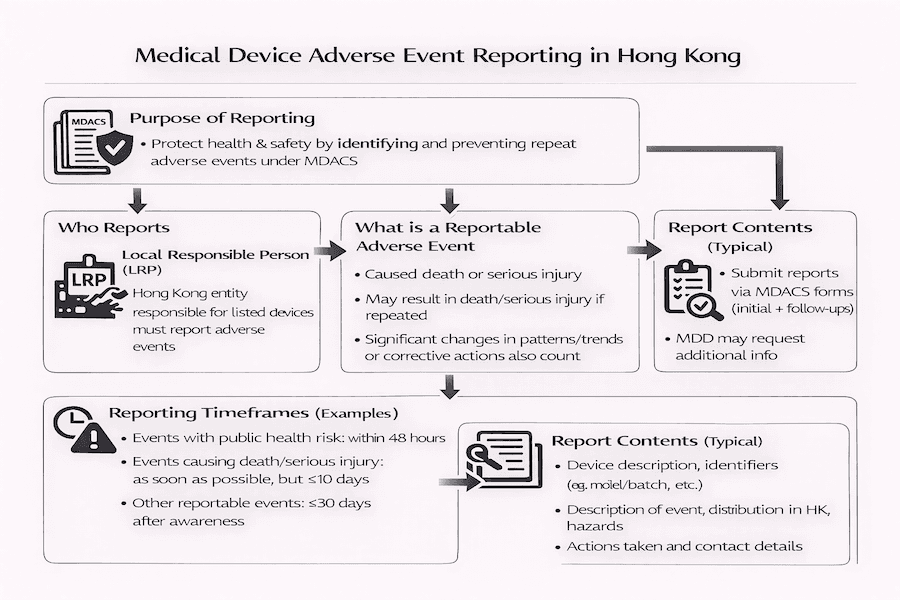
根據我們的觀察,香港的醫療儀器行政管理制度 (MDACS) 非常重視醫療儀器上市後的監測。其中,不良事件呈報是核心環節。不良事件呈報系統(詳見如 GN-03-E 等指引)的主要目標很明確:就是為了更好地保障公共衛生和安全。它如何做到這一點呢? 透過收集和傳播有關所發生問題的資訊,我們可以從中學習,並防止醫療儀器相關的類似問題再次發生。這對於香港醫療儀器安全至關重要。
儘管 MDACS 目前是一個行政管理系統(意味著它還不是一項嚴格的法律),但根據我們的經驗,其健全的不良事件呈報機制,能確保潛在風險被迅速識別、調查和處理。這最終保障了使用者和患者的安全。
呈報責任人是誰?我們對本地負責人 (LRP) 角色的理解
根據 MDACS,本地負責人 (LRP) 承擔呈報和管理在香港發生、涉及其已上市醫療儀器不良事件的主要責任。從我們的角度來看,這確實突顯了 LRP 的重要性——他們是製造商、衛生署醫療儀器科 (MDD) 以及其他利益相關者之間的關鍵聯絡人。他們的角色對於香港監管合規至關重要。
何謂應呈報的不良事件?讓我們來解釋一下。
那麼,什麼樣的事件會被認定為「應呈報的不良事件」呢? 一般來說,我們指的是任何涉及醫療儀器,並已導致或可能導致某些嚴重後果的事件。雖然確切的定義詳載於官方指引中,但根據我們的經驗,通常包括導致以下結果的事件:
- 病人、儀器使用者或其他人死亡。
- 病人、使用者或其他人嚴重受傷。
- 若該事件再次發生,可能導致死亡或嚴重受傷。
這也延伸到 LRP 或製造商發現問題的趨勢或模式發生重大變化,且可能導致嚴重傷害的情況;或者當他們採取糾正措施以防止此類傷害時。這些事件對於醫療儀器警戒至關重要。
呈報時限:為什麼速度很重要?
為什麼及時呈報這些事件如此重要呢? 因為及時呈報能夠確保迅速展開調查並採取適當的行動。MDACS 為向 MDD 呈報這些事件設定了具體的時限,根據我們的理解,這些時限通常會根據事件的嚴重性和性質而有所不同:
- 「加急呈報」(意味著非常迅速,有時在 2 或 10 個日曆日內)適用於導致死亡或嚴重受傷的事件,或那些對公共衛生構成嚴重威脅的事件。
- **「後續呈報」**在調查進展期間是必要的,用來提供更多詳細資訊。
- **「最終呈報」**在調查完成後提交,詳述所有調查結果以及採取的任何糾正及預防措施 (CAPA)。
不良事件調查流程:我們的經驗
一旦 MDD 收到不良事件呈報,他們可能會要求 LRP 對事件進行非常徹底的調查。 LRP 負責這項調查,通常會與儀器製造商或其他相關方合作,或在他們的協助下進行。調查的主要目標是找出事件發生的原因,識別促成因素,並實施必要的糾正措施以防止再次發生。LRP 必須向 MDD 提交詳細的調查結果和建議報告。另外,重要的是要記住,MDD 始終保留在認為必要時進行獨立調查的權利。這確保了香港醫療儀器規管中的問責制。
為何全面文件記錄和上市後監測至關重要?
從我們的角度來看,有效的不良事件呈報,很大程度上取決於製造商和 LRP 為監測上市後儀器所建立的健全系統。這包括什麼呢?
- 建立清晰的書面程序,用於識別、評估和呈報不良事件。
- 維護所有投訴、調查和已採取糾正措施的全面記錄。
- 確保儀器可追溯(追溯性),以便在必要時能快速有效地進行召回。
根據我們的經驗,及時了解 MDD 發布的最新指引和監管更新對於持續合規至關重要。 這種持續的努力顯著有助於香港市場醫療儀器的整體安全和品質。
有任何問題?
我們會親自跟進回覆您。
相關文章
約5分鐘
香港醫療儀器不良事件呈報:本地負責人 (LRP) 指南
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港的醫療器械法規和註冊 (Medical Device Regulations and Registration)
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
深入了解香港醫療儀器規管:MDACS 框架
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。