2025年6月14日
約5分鐘
深入了解香港醫療儀器規管:MDACS 框架
深入了解香港的醫療儀器規管:MDACS 框架 (我們的見解)
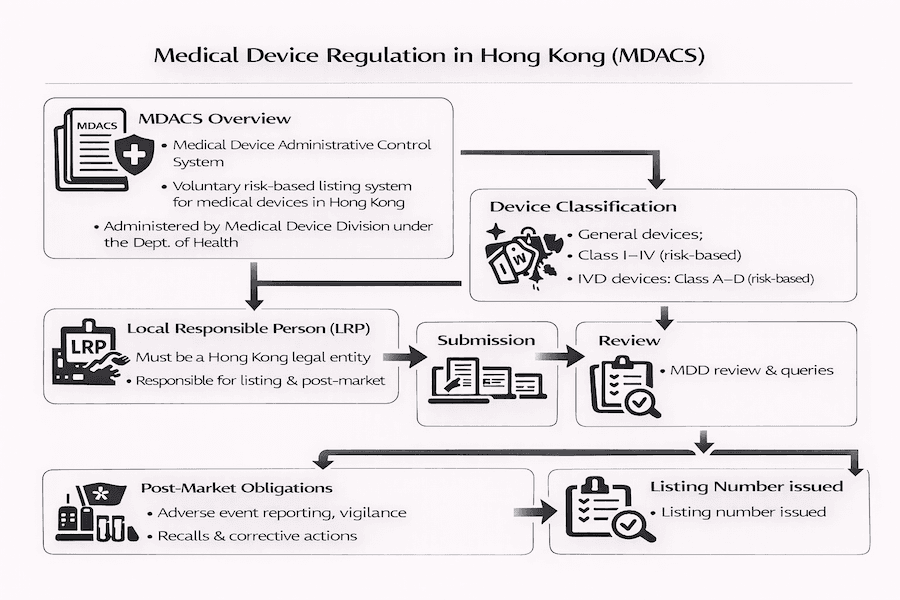
根據我們的觀察,香港目前透過一套獨特的系統來管理醫療儀器,這就是醫療儀器行政管理制度 (MDACS)。它是由衛生署 (DH) 於2004年11月推出,並由其醫療儀器科 (MDD) 管理。根據我們的理解,MDACS 是基於「風險」來運作的。這對您來說意味著什麼呢? 它簡單來說就是,儀器的潛在風險越高,監管的規則和審查就越嚴格。其主要目標是確保所有在香港供應的醫療儀器都是安全、有品質且能正常運作的。
根據我們的經驗,這套系統遵循國際最佳實踐,汲取了國際醫療儀器監管機構論壇 (IMDRF) 等全球組織的原則。我們將 MDACS 視為一個過渡性的安排,為未來更正式的醫療儀器法律框架鋪路。
醫療儀器如何在香港分類?了解風險類別
在 MDACS 下,醫療儀器會根據它們可能對病人及使用者構成的風險,被分為四個不同的類別。這個分類至關重要,因為它直接影響監管機構對您儀器的審查程度。
一般醫療儀器:
- 第一級(低風險): 這些是最簡單、風險最低的儀器。您可以想像一下日常用品,例如壓舌板或普通繃帶。
- 第二級(中低風險): 這些儀器涉及的風險會稍高一點。常見的例子包括隱形眼鏡或助聽器。
- 第三級(中高風險): 我們認為這些是風險較高的儀器。這個組別包括像醫院使用的呼吸機或髖關節植入物等物品。
- 第四級(高風險): 這些是最關鍵的儀器,任何故障都可能導致非常嚴重的後果。根據我們的經驗,心臟起搏器和心臟瓣膜就屬於這個最高風險類別。
同樣,體外診斷 (IVD) 醫療儀器(那些用於體外檢測樣本,例如血液測試的儀器)也被分為甲、乙、丙、丁類,風險從低到高。MDD 提供了一些實用的指南(稱為技術參考文件,例如通用醫療儀器的 TR-003 和體外診斷儀器的 TR-006),以幫助製造商根據預期用途、與身體接觸的時間長短、侵入性以及潛在危害等因素,確定正確的分類。
自願上市制度:為什麼它仍然至關重要?
MDACS 的一個核心部分是其針對中高風險醫療儀器(即第二、三、四級通用儀器和體外診斷儀器乙、丙、丁級)的自願上市制度。那麼,上市是強制性的嗎?目前還不是所有儀器都強制,但根據我們的觀察,它帶來了巨大的優勢。 香港的公立醫院和其他主要的採購機構越來越傾向於,在某些情況下甚至要求採購 MDACS 上市的儀器。根據我們的經驗,這種日益增長的偏好實際上使得自願上市成為在香港市場有效準入的「事實必要條件」。 儀器一旦上市,其批准通常有效期為五年,因此密切關注續期日期非常重要。
本地負責人 (LRP) 的關鍵作用:我們的經驗
對於任何希望在香港供應醫療儀器的境外製造商而言,指定一名本地負責人 (LRP) 是一項強制性要求。誰是 LRP? 您可以將他們視為您與進口商、分銷商、儀器使用者以及醫療儀器科之間的重要本地聯絡橋樑。根據我們的經驗,他們的職責範圍非常廣泛且至關重要,對於順暢的運營來說不可或缺,其中包括:
- 管理儀器上市的所有申請。
- 確保溝通渠道保持暢通。
- 處理投訴並追蹤儀器的流向(可追溯性)。
- 報告已上市儀器的任何變更。
- 最重要的是,向 MDD 報告不良事件(任何意想不到的問題或事故)。MDACS 有一個內建的不良事件報告系統,從我們的角度來看,它對於調查事件以防止再次發生並加強公共衛生保護至關重要。
上市申請程序:根據我們的經驗,您會遇到什麼?
根據我們的經驗,獲得自願儀器上市的一般步驟通常包括:
- 儀器分類: 首先,您需要準確確定您儀器的風險類別。我們發現這第一步為之後的所有工作奠定了基礎。
- LRP 指定: 然後,您需要在香港指定一名合格的 LRP。
- 文件匯編: 這是許多細節工作發生的地方。您(或您的 LRP)需要準備一套全面的申請文件。根據我們的經驗,確保這份「檔案」符合國際提交指南(例如來自 GHTF/IMDRF 的指南)會非常有幫助。
- 提交與審查: 您的 LRP 會將申請提交給 MDD 進行評估。根據我們的觀察,MDD 在審查期間可能會要求提供額外資訊,因此及時回應至關重要!
- 上市批准: 如果審查一切順利,MDD 將會為您的儀器發出一個獨特的上市編號,並將��添加到他們的公開在線數據庫中。
如果您的儀器已經在其他地方獲得批准了呢? 那些已在認可的「參考國家」(例如美國、歐盟、加拿大、日本、澳洲、韓國或中國內地)獲得批准的製造商,可能會受益於更快或更簡單的審查途徑——這是一個我們經常看到被充分利用的巨大優勢。
市場准入與粵港澳大灣區 (GBA):拓展市場版圖
MDACS 上市的重要性不僅限於香港市場本身,它也日益成為進入充滿機遇的粵港澳大灣區 (GBA) 的潛在門戶。根據我們的理解,像大灣區互聯互通計劃這樣的舉措,正允許已在香港註冊的醫療儀器在大灣區內經批准的醫療機構中使用。從我們的角度來看,這為製造商帶來了巨大的擴展機會,使香港成為一個更具戰略意義的市場切入點。
未來展望:保持領先地位
儘管 MDACS 目前作為一個行政管理制度運作,但我們知道香港一直在認真考慮過渡到一個強制性的醫療儀器法定框架。 這種潛在的轉變,凸顯了香港持續致力於加強監管監督,確保該地區醫療儀器最高安全和品質標準的承諾。我們對製造商和 LRP 的建議是,務必隨時關注最新的指引和任何新的立法動態,因為這對於確保您持續符合規定並能夠進入這個充滿活力的市場至關重要。
有任何問題?
我們會親自跟進回覆您。
相關文章
約5分鐘
香港醫療儀器不良事件呈報:本地負責人 (LRP) 指南
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港的醫療器械法規和註冊 (Medical Device Regulations and Registration)
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
深入了解香港醫療儀器規管:MDACS 框架
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。