ElendiLabs
虽然进口商有义务记录并向 LRP 报告质量问题,但根据 COP-01 守则,LRP 是法定的唯一沟通窗口。在发生严重事故(AE)或召回(FSCA)时,LRP 必须在 10 天内向 MDD 提交报告。 • 沟通路径: 列名进口商不能越过 LRP 直接处理行政程序。这种“独立 LRP + 商业进口商”的模式在 2026 年最为推荐,因为它能防止您的列名资格因更换经销商而失效,同时也确保了监管合规的专业性。
2025年5月3日
約5分鐘
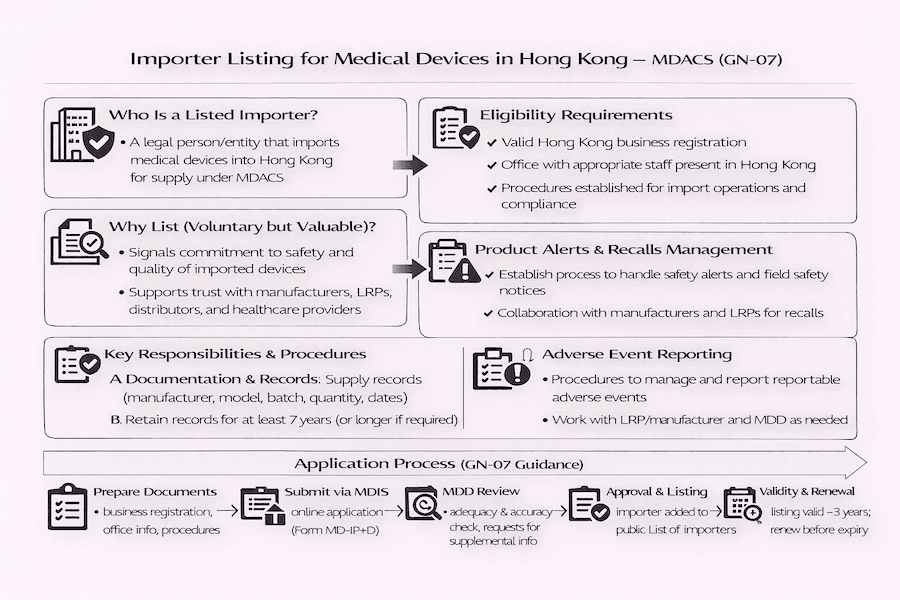
根據我們的觀察,香港的醫療儀器行政管理制度 (MDACS) 不僅僅是關於醫療儀器本身的上市;它也密切關注供應鏈中的所有參與者。對於將醫療儀器進口至香港的公司,《醫療儀器進口商上市指南》 (GN-07) 詳細闡述了根據該制度自願上市的具體步驟和要求。儘管目前並非強制性,但根據我們的經驗,選擇上市顯示了您對香港醫療儀器市場品質和合規性的堅定承諾。 這對於任何香港醫療儀器進口商來說都是關鍵一步。
當我們在香港談論「醫療儀器」時,香港衛生署醫療儀器科 (MDD) 究竟認定什麼是醫療儀器呢?根據他們的指引,醫療儀器本質上是任何儀器、器具、機械、電器、植入物、體外診斷試劑或校準器、軟件、材料或其他類似或相關物品。重要的是,製造商預期這些物品是單獨使用或組合使用,為人類達到一個或多個特定的醫療目的。
這些目的包括:
關鍵的是,醫療儀器不會透過藥理、免疫或代謝方式在人體內部或表面實現其主要預期作用,但其預期功能可能會得到這些方式的輔助。因此,它的範圍相當廣泛,從簡單的繃帶到複雜的診斷軟件都涵蓋在內!
那麼,在 MDACS 的背景下,特別是針對醫療儀器,什麼是「進口商」呢? 一般來說,「進口商」是指將任何受 MDACS 規範的醫療儀器引入或安排引入香港,以便在這裡銷售或供應的法人實體。根據我們的理解,這個定義通常不包括僅為個人使用而進口儀器的個人。 這種區別對於香港醫療儀器規管至關重要。
任何在香港設有適當人員的辦事處,並負責醫療儀器進口業務的法人實體,都可以申請列入「進口商名單」。根據我們的經驗,進口商的自願上市能帶來多項明顯優勢:
要根據 MDACS 上市,進口商需要建立、實施並持續維護一套文件化的程序。這裡的重點是什麼呢? 這些程序對於妥善控制和管理進口醫療儀器至關重要,確保它們從抵達香港到分銷的整個過程中的安全和品質。它們應涵蓋以下重要領域:
準備好申請了嗎?根據我們為客戶提供指導的經驗,作為醫療儀器進口商在香港上市的流程通常包括以下步驟:
作為醫療儀器進口商上市並非一次性事件;這是一項持續的承諾。 根據我們的經驗,已上市的進口商應持續維護並實施其文件化的程序,更新其記錄,並及時向 MDD 通報任何相關變更或事件。 這種持續的奉獻對於維護醫療儀器供應鏈的可靠性並確保香港的公共衛生保護至關重要。這是為了在香港醫療保健市場中長期維持信任和安全。
我們會親自跟進回覆您。
ElendiLabs
虽然进口商有义务记录并向 LRP 报告质量问题,但根据 COP-01 守则,LRP 是法定的唯一沟通窗口。在发生严重事故(AE)或召回(FSCA)时,LRP 必须在 10 天内向 MDD 提交报告。 • 沟通路径: 列名进口商不能越过 LRP 直接处理行政程序。这种“独立 LRP + 商业进口商”的模式在 2026 年最为推荐,因为它能防止您的列名资格因更换经销商而失效,同时也确保了监管合规的专业性。
Anonymous
我们在香港有三家不同的经销商,分别负责公立医院、私立诊所和零售药店。根据 GN-07 指南,我们可以将这三家全部登记为‘列名进口商’吗?如果其中一家进口商因为违反《医疗器械实务守则》(Code of Practice) 被除名,是否会连带影响我们的产品表列号 (HKMD No.) 或其他两家进口商的进口资格?
ElendiLabs
您可以授权无限数量的列名进口商。通过 LRP 在 MDIS (医疗器械信息系统) 门户操作,只需提交每家进口商的商业登记证 (BR) 及对应的授权书。 连带影响: 2026 年的监管趋于精准化。单个进口商的违规(如仓储温控不达标)通常只会导致该特定进口商从您的产品表列名单中移除,不会自动撤销产品的 HKMD 编号。但是,如果违规涉及系统性质量问题(如篡改标签),MDD 可能会要求 LRP 解释,严重时会暂停整个产品的进口。
Anonymous
我们目前的进口商仅具备基础的商业登记。面对即将立法的 CMPR 框架,进口商是否必须获得 ISO 13485 认证?
ElendiLabs
目前 MDACS 仅要求进口商遵循“Code of Practice”。但 2026 年 CMPR 预览版建议,处理 Class III/IV 高风险设备的进口商需建立符合 ISO 13485 (或同等标准) 的质量管理体系。
約5分鐘
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。
約5分鐘
本文詳細闡述了根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-06 指引) 申請將乙、丙、丁類體外診斷醫療儀器 (IVDMDs) 上市的程序。內容涵蓋分類、申請資格、提交要求以及透過MDIS在線申請,所有這些都基於我們對高效香港 IVDMD 上市的見解和經驗。
Anonymous
我们计划聘请 ElendiLabs 作为独立 LRP 以掌握产品所有权,但我们的商业合作伙伴希望作为列名进口商。在2026年的合规要求下,如果发生产品召回,由谁负责向卫生署医疗器械分部 (MDD) 提交初步报告?进口商是否可以直接与 MDD 沟通,还是必须通过我们的 LRP?