ElendiLabs
具有“指定值 (Assigned Values)”的校准品和质控品必须与主试剂保持一致,即 Class D,不能降级。 • 附件区分: 只有不具备特定诊断功能的通用耗材(如普通的样本杯或非特异性洗涤液)可以作为 Class A。但在 2026 年的 MDIS 系统申报中,为了确保 Stage C 采购流程的完整性,建议将整个 Test System 作为一个“系统 (System)”进行整体列名,这样可以避免因配件表列号缺失而导致医院收货受阻。
2025年6月2日
約5分鐘
根據我們的觀察,將體外診斷醫療儀器 (IVDMDs) 引入香港市場,需要仔細地遵守醫療儀器行政管理制度 (MDACS)。這個由衛生署管理的系統,為醫療儀器的自願上市提供了一個清晰的框架。對於涉及乙、丙、丁類 IVDMDs 的申請,具體的程序詳細說明在**《乙、丙、丁類體外診斷醫療儀器上市指南》 (GN-06)** 中。根據我們的經驗,這份指南對於希望將這些重要儀器引入香港市場的製造商和本地負責人 (LRP) 來說,絕對是不可或缺的。
在您啟動上市流程之前,正確地對 IVDMD 進行分類至關重要。那麼,什麼是體外診斷醫療儀器(IVDMD)呢? 簡單來說,它們是用於體外檢查人體樣本(例如血液或尿液),以提供診斷、監測或兼容性信息目的的醫療儀器。根據我們的理解,與通用醫療儀器類似,IVDMDs 根據風險分為四個類別:
IVDMD 的分類取決於其預期用途、預期使用者的專業知識、其提供的診斷信息的重要性以及測試結果對個人和公共衛生的影響等因素。技術參考文件 TR-006 提供了詳細的 IVDMD 分類規則和範例。香港醫療儀器一般是如何分類的呢? 在香港,所有醫療儀器都是根據它們相關的風險進行分類。這個系統有助於確保風險較高的儀器會受到更嚴格的檢查和控制,以保障公眾安全。這個分類是香港醫療儀器註冊的基礎步驟。
將乙、丙、丁類 IVDMDs 納入 MDACS 醫療儀器名單的申請,必須由本地負責人 (LRP) 提交。那麼,誰可以成為本地負責人(LRP)呢? 根據我們的經驗,LRP 可以是:
根據我們的理解,如果您是沒有香港註冊業務的外國製造商,您絕對必須指定一名 LRP 代表您行事。 這是香港 IVDMD 上市的關鍵一步。
根據 GN-06 的概述,乙、丙、丁類 IVDMDs 的上市申請程序通常遵循以下步驟:
準備申請文件:
透過 MDIS 線上提交:
MDD 評估:
上市和認證:
透過仔細遵循 GN-06 和其他相關 MDACS 指南中概述的程序,製造商和 LRPs 可以成功完成香港乙、丙、丁類 IVDMDs 的上市程序,確保這些重要儀器能夠用於公共衛生。
我們會親自跟進回覆您。
ElendiLabs
具有“指定值 (Assigned Values)”的校准品和质控品必须与主试剂保持一致,即 Class D,不能降级。 • 附件区分: 只有不具备特定诊断功能的通用耗材(如普通的样本杯或非特异性洗涤液)可以作为 Class A。但在 2026 年的 MDIS 系统申报中,为了确保 Stage C 采购流程的完整性,建议将整个 Test System 作为一个“系统 (System)”进行整体列名,这样可以避免因配件表列号缺失而导致医院收货受阻。
約5分鐘
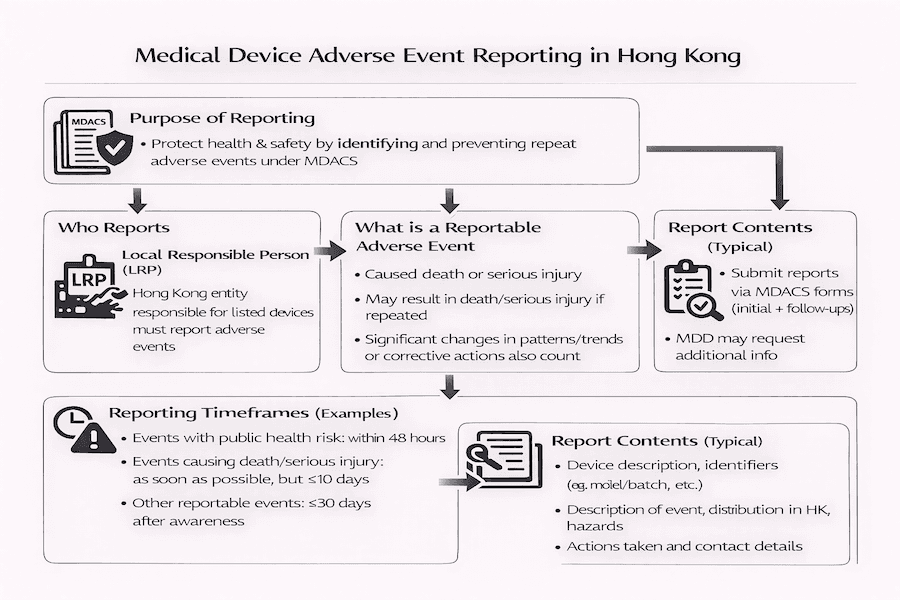
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。
約5分鐘
本文詳細闡述了根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-06 指引) 申請將乙、丙、丁類體外診斷醫療儀器 (IVDMDs) 上市的程序。內容涵蓋分類、申請資格、提交要求以及透過MDIS在線申請,所有這些都基於我們對高效香港 IVDMD 上市的見解和經驗。
Anonymous
我们计划注册一套高风险传染病检测系统 (Class D)。系统中包含专用校准品、质控品以及通用的洗涤缓冲液。根据 TR-006 Rule 5 和 Rule 7,这些配件必须全部作为 Class D 申报吗?我们能否将通用的洗涤液作为 Class A 附件单独处理,以简化技术文档的更新