2025年6月23日
約5分鐘
香港通用醫療儀器分類:TR-003 指南
安全分類:香港通用醫療儀器分類 – 我們的見解
根據我們的觀察,香港的醫療儀器行政管理制度 (MDACS) 採用了一套巧妙的系統,根據醫療儀器的風險進行分類。這一切都是為了確保每種儀器都能得到適當的監管監督。對於通用醫療儀器,所有具體的分類規則和原則都清晰地詳載於技術參考文件 TR-003,其標題為《通用醫療儀器分類》。根據我們的理解,這份文件至關重要,因為它直接影響製造商和本地負責人 (LRP) 所需的「符合性評估」(證明您的儀器符合標準)類型,以及在 MDACS 下的整個上市流程。這是香港醫療儀器分類的基礎步驟。
根據我們的經驗,TR-003 中的分類原則不僅僅是本地規定;它們與國際指南完全一致,特別是國際醫療儀器監管機構論壇 (IMDRF) 所頒布的指南。這確實有助於在全球範圍內保持香港醫療儀器規管的一致性。
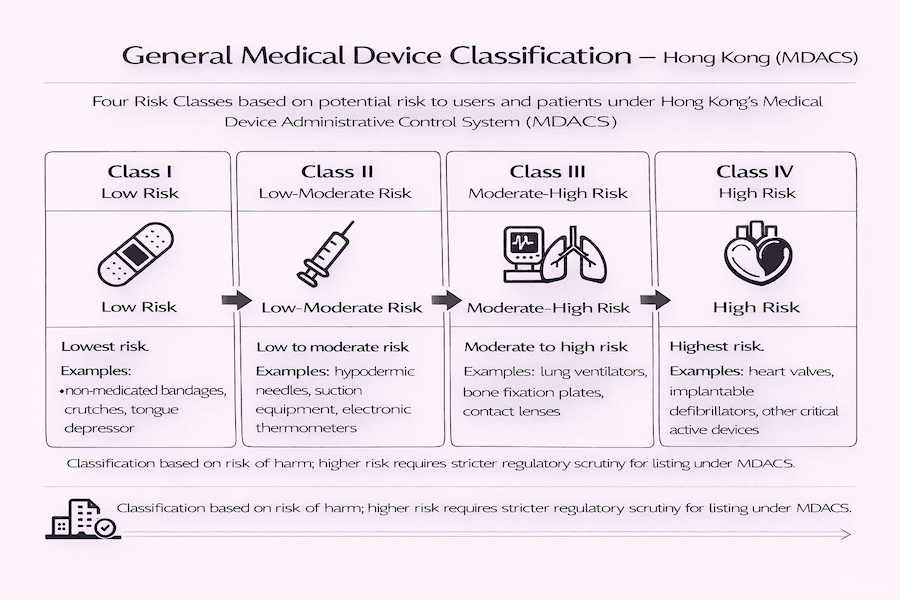
四個風險類別:您的儀器風險有多高?
您是否曾好奇醫療儀器是如何分類的呢? MDACS 下的通用醫療儀器分為四個不同的類別。這些類別的風險從最低到最高不等,這對您意味著什麼呢? 風險越高,您的儀器將面臨越嚴格的審查。
- 第一類(低風險): 這些是風險最低的儀器。您可以想像一下簡單的日常用品,例如非藥用繃帶、拐杖或壓舌板。根據我們的理解,這些儀器通常不需要在 MDACS 下上市。
- 第二類(中低風險): 這些儀器帶有中低度風險。我們常見的例子是皮下注射針頭、吸痰設備或電子溫度計。
- 第三類(中高風險): 這些儀器被認為是中高風險。這個組別包括像肺部呼吸機、骨板或隱形眼鏡等物品。
- 第四類(高風險): 這些是風險最高的儀器。我們指的是心臟瓣膜、植入式除顫器或其他植入體內的活性儀器等關鍵物品。
根據我們的經驗,您的儀器風險類別越高,監管控制就越嚴格,上市所需的證據也越廣泛。
分類原則:什麼決定了您的儀器類別?
TR-003 概述了一系列分類規則。那麼,究竟是什麼決定了您的特定儀器屬於哪一類呢? 它的分類取決於其設計和預期用途相關的一個或多個因素。這些因素可能單獨或組合地影響儀器分類:
- 與身體接觸的持續時間: 您的儀器接觸身體的時間有多長? 是瞬時、短期還是長期使用?
- 侵入程度: 您的儀器是否穿破皮膚或進入體內? 是非侵入性、侵入性(例如,穿透身體孔道或經由手術侵入性)還是可植入的?
- 藥品或能量的傳遞: 您的儀器是否傳遞藥品或能量? 這種傳遞的性質是什麼?
- 生物效應或全身/局部效應: 您的儀器是否旨在產生生物效應(例如與細胞相互作用)或被身體吸收?
- 與其他醫療儀器組合使用: 如果您的儀器設計為與其他醫療儀器組合使用,其分類可能會受到它們組合預期用途的影響。
- 獨立軟件: 您的軟件本身是否屬於醫療儀器? 如果它符合資格,其分類取決於其自身的預期用途和相關風險。獨立軟件通常被視為一種主動式儀器。
分類規則的應用:我們的實踐方法
TR-003 提供了一種系統的方法來應用這些分類規則。那麼,我們對如何有效執行這項工作的建議是什麼呢?
- 逐步評估: 我們始終指導製造商系統地根據每條規則評估其儀器。
- 最高類別原則:如果有多條規則適用怎麼辦? 這是一個常見問題!如果您的儀器可以歸入多個類別,則必須採用導致最高分類(即最大風險)的規則。從我們的角度來看,這種保守的方法旨在確保您的儀器按照最嚴格的標準進行監管,優先保障病人安全。
- 範例和解釋: 文件本身提供了分類通用醫療儀器的有用範例,以說明規則在實踐中的應用。然而,重要的是要記住,正如我們一直強調的,您的特定儀器的最終分類確實取決於其實際設計、預期用途和其他特定因素。 不要只依賴範例;請深入研究您的具體產品細節。
製造商的責任和 LRP 的作用:攜手合作,共創成功
製造商最終有責任根據 TR-003 中的規則正確分類其醫療儀器。我們強烈建議您記錄將您的產品分配到特定風險類別的理由。 這份理由在審查過程中會非常有幫助。
根據我們的經驗,香港的本地負責人 (LRP) 在協助外國製造商進行此分類方面發揮著關鍵作用。他們確保提交的上市申請準確反映儀器的正確風險類別。為什麼正確的分類如此重要? 因為它是滿足所有後續符合性評估要求並成功完成整個 MDACS 上市流程的基礎。根據我們的理解,錯誤分類可能導致審批延遲甚至不合規,這是大家都不希望看到的!
透過認真應用 TR-003 中的原則和規則,製造商有助於確保投放香港市場的醫療儀器得到適當的監管,從而促進病人安全和公共衛生。
有任何問題?
我們會親自跟進回覆您。
相關文章
約5分鐘
香港醫療儀器不良事件呈報:本地負責人 (LRP) 指南
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港的醫療器械法規和註冊 (Medical Device Regulations and Registration)
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
深入了解香港醫療儀器規管:MDACS 框架
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。
約5分鐘
香港醫療儀器本地製造商上市程序:GN-08 指南
本文詳細闡述了香港醫療儀器本地製造商根據醫療儀器行政管理制度 (MDACS) (依循 GN-08 指引) 申請上市的程序。內容涵蓋申請資格、質量管理體系要求以及提交流程,所有這些都基於我們對高效香港醫療儀器製造的見解和經驗。
約5分鐘
香港醫療儀器進口商上市程序:GN-07 指南
對於將醫療儀器進口至香港的實體,醫療儀器行政管理制度 (MDACS) 提供了一項進口商自願上市計劃,依循 GN-07 指引。本文根據我們的見解和經驗,詳細闡述了作為醫療儀器進口商上市的資格、申請步驟和主要要求,以實現高效的香港醫療儀器進口。
約5分鐘
香港醫療儀器分銷商上市程序:GN-09 指南
本文概述了醫療儀器分銷商根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-09 指引) 申請上市的程序。內容涵蓋申請資格、文件化程序的主要要求以及提交流程,旨在加強可追溯性和公共安全,這都是基於我們的見解。
約5分鐘
香港乙、丙、丁類體外診斷醫療儀器上市程序:GN-06 指南
本文詳細闡述了根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-06 指引) 申請將乙、丙、丁類體外診斷醫療儀器 (IVDMDs) 上市的程序。內容涵蓋分類、申請資格、提交要求以及透過MDIS在線申請,所有這些都基於我們對高效香港 IVDMD 上市的見解和經驗。