2025年6月23日
約5分鐘
香港醫療儀器註冊:基本要求和程序
香港醫療儀器註冊:基本要求和程序 – 我們的見解
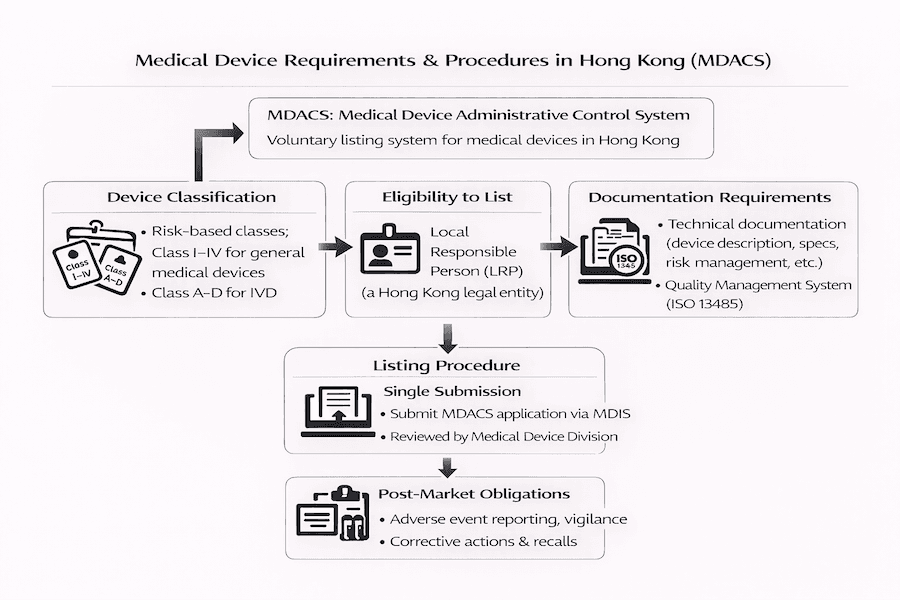
根據我們的觀察,要在香港將您的醫療儀器上市,意味著必須了解並遵循醫療儀器行政管理制度(MDACS)。本指南基於我們的經驗,旨在為您清晰、循序漸進地介紹相關的基本要求和程序。這一切都是為了確保您的儀器準備好進入香港醫療保健市場。
基本要求:您絕對需要準備什麼?
那麼,您絕對需要具備哪些基本要素呢?讓我們深入探討一下:
1. 儀器分類:您的儀器風險有多高?
您是否曾好奇醫療儀器在香港是如何分類的呢? 根據我們的理解,MDACS 採用基於風險的系統,將儀器分為四個主要類別:
- 第一類(低風險儀器): 想像一下簡單的日常用品,例如非藥用繃帶或拐杖。
- 第二類(中等風險儀器): 這包括像皮下注射針頭或電子體溫計等物品。
- 第三類(高風險儀器): 較為複雜的儀器,例如肺部呼吸機或隱形眼鏡。
- 第四類(最高風險儀器): 關鍵性物品,例如心臟瓣膜或植入式除顫器。
為什麼這個分類如此重要? 因為,根據我們的經驗,您的儀器風險類別越高,監管審查就越嚴格,您需要為香港醫療儀器註冊提供的證據也就越多。
2. 製造商要求:對您的期望是什麼?
作為製造商,您有幾項關鍵責任。我們通常認為哪些方面至關重要呢?
- 必須持有有效製造許可證: 這是您營運的基本許可證。
- 必須實施質量管理系統: 根據我們的理解,這通常意味著您需要建立像 ISO 13485 這樣的系統,以確保品質的一致性。這對於香港醫療儀器合規至關重要。
- 必須維護技術文件: 詳細記錄您的儀器設計、製造和測試資訊。
- 必須符合國際標準: 與全球基準保持一致有助於確保您的儀器符合高安全和性能標準。
3. 本地負責人(LRP):您在香港的夥伴
對於外國製造商而言,指定一名**本地負責人(LRP)**是不可協商的。那麼,LRP 究竟做什麼,為什麼他們如此重要?
- 必須是香港註冊公司: 他們必須是本地的合法實體。
- 必須持有有效商業登記: 這證明了他們的合法性。
- 必須維護適當文件: 他們協助您整理所有本地文件。
- 必須確保監管合規: 根據我們的經驗,LRP 充當您與醫療儀器科(MDD)的主要聯絡人,確保符合所有香港醫療儀器法規。這個角色對於香港 LRP 要求至關重要。
註冊程序:您如何獲得上市資格?
準備好讓您的儀器正式上市了嗎?以下是我們循序漸進的程序指南:
1. 提交前準備:整理所有文件
在您點擊「提交」之前,充分的準備是避免延誤的關鍵。在這個階段,您應該專注於什麼呢?
- 填寫申請表: 準確填寫所有必要的表格。
- 準備技術文件: 這就是您的**摘要技術文件(STED)**發揮作用的地方,它是您儀器技術檔案的簡明摘要。
- 整理支持文件: 收集所有證書、測試報告和其他證明文件。
- 確保符合所有要求: 根據 MDACS 指南仔細核對所有要求。
2. 文件要求:您需要哪些文件?
MDD 會尋找哪些詳細信息呢? 根據我們的經驗,一份全面的申請檔案通常包括:
- 儀器描述和規格: 您的儀器是什麼,其主要特點是什麼?
- 製造信息: 它是如何製造的,在哪裡製造?
- 質量控制程序: 您如何在生產過程中確保其品質?
- 風險分析和管理: 存在哪些風險,您如何控制它們?
- 臨床評估數據: 證明您的儀器在實際使用中的表現。
- 標籤和說明: 所有包裝、儀器標籤和安全使用說明。這就是香港額外標籤要求(TR-005)的重點,確保內容是雙語的。
3. 質量管理系統:證明您對品質的承諾
健全的質量管理系統(QMS)是 MDACS 的核心。這對您來說意味著什麼呢?
- 必須符合 ISO 13485: 這是醫療儀器 QMS 的國際公認標準。
- 必須包括質量控制程序: 監測和維持產品品質的步驟。
- 必須維護適當文件: 記錄所有 QMS 活動。
- 必須進行定期審計: 定期審查您的 QMS,以確保其有效性。
特殊考慮:獨特情況
是否存在需要額外關注的獨特情況?絕對有。根據我們的經驗,以下是一些關鍵領域:
1. 定制設備:專為一人打造
如果您的儀器是專為特定患者製造的呢? 這些「定制」儀器有其獨特的規定:
- 特殊文件要求: 通常需要更個性化的記錄。
- 質量控制措施: 即使是單次生產也要確保品質。
- 風險管理程序: 評估針對個別患者的特定風險。
- 上市後監測: 即使是定制儀器也需要監測。
2. 臨床調查:真實世界測試
如果您的儀器需要進行臨床試驗,則有特定的步驟。您應該為哪些方面做好準備?
- 批准要求: 獲得研究所需的批准。
- 文件需求: 詳細的研究計劃和記錄。
- 安全監控: 在研究期間持續檢查任何不良事件。
- 報告要求: 向 MDD 提交調查結果。
3. 進出口要求:跨境運輸您的儀器
考慮將您的儀器引入香港或運出香港嗎? 您需要了解:
- 進口許可證要求: 您的儀器是否需要特殊許可才能入境?這與香港醫療儀器進口相關。
- 出口文件: 國際運輸需要哪些文件?
- 海關清關程序: 處理邊境管制的物流問題。
- 監管合規: 確保您符合所有貿易和安全法規。
上市後要求:上市後會發生什麼?
上市就是您責任的終點嗎?根據我們的經驗,絕對不是! 維護香港醫療儀器合規是一項持續的承諾。
1. 警戒系統:保持警惕
設備上市後如何確保安全? 香港 MDACS 強調健全的警戒系統:
- 不良事件報告: 及時向 MDD 報告任何問題或事故。這對於香港醫療儀器不良事件報告至關重要。
- 現場安全糾正措施: 採取必要措施糾正已分銷儀器的問題。
- 召回程序: 制定清晰的計劃,將不安全的儀器從市場上召回。
- 溝通要求: 讓所有利益相關者知情。
2. 持續合規:永續的旅程
持續合規在實踐中意味著什麼?
- 文件更新: 保持您的技術檔案和記錄最新。
- 質量系統維護: 定期審查和改進您的 QMS。
- 定期審計: 進行內部和外部檢查,以確保符合標準。
- 變更管理: 適當管理和報告對您已上市儀器的任何修改(根據 GN-10)。這確保了持續的香港上市後監測。
聯繫方式
如需進一步資訊或協助,我們始終建議您聯繫官方來源:
- 衛生署醫療儀器科
重要注意事項:我們的實用建議
根據我們的經驗,以下是一些需要牢記的關鍵要點:
1. 合規時間表:提前規劃!
- 預留足夠審查時間: 註冊流程可能需要一段時間,因此耐心和規劃是關鍵。
- 計劃額外信息請求: MDD 要求提供更多詳細信息是很常見的;及時回應至關重要。
- 考慮上市後要求: 從一開始就將持續警戒和合規成本考慮在內。
- 監控監管更新: 隨時了解規則的任何變化。
2. 最佳實踐:我們的成功秘訣
- 及早與 MDD 接觸: 不要猶豫提出問題。
- 完整文件準備: 全面的檔案能顯著加快流程。
- 定期合規監控: 密切關注您的內部流程。
- 維護適當記錄: 良好的記錄保存從長遠來看會讓一切變得更容易。
3. 成本考慮:投資方面如何?
您應該預期哪些成本?
- 申請費用: 提交上市申請的費用。
- 測試成本: 與所需安全和性能測試相關的成本。
- 持續合規成本: 維護您的 QMS、LRP 服務和上市後活動的費用。
- 文件維護: 維護您的技術檔案更新的成本。
根據我們的理解,透過牢記這些方面,您可以自信地處理香港的醫療儀器註冊,並確保更順利地在市場上取得成功。
有任何問題?
我們會親自跟進回覆您。
相關文章
約5分鐘
香港醫療儀器不良事件呈報:本地負責人 (LRP) 指南
不良事件呈報是香港醫療儀器行政管理制度 (MDACS) 的關鍵組成部分,旨在加強公共衛生和安全。本文根據我們的見解,概述了本地負責人 (LRP) 在呈報已上市醫療儀器相關不良事件方面的要求和職責。
約5分鐘
香港的醫療器械法規和註冊 (Medical Device Regulations and Registration)
香港醫療器械法規、分類、註冊要求和上市後監督的完整指南。包括 MDACS 系統、質量管理和國際協調要求。
約5分鐘
深入了解香港醫療儀器規管:MDACS 框架
香港的醫療儀器行政管理制度 (MDACS) 為醫療儀器規管提供了一個健全但目前屬自願性質的框架。本文將深入探討該制度的主要特點,包括儀器分類、上市程序、本地負責人 (LRP) 的關鍵作用,以及其對市場准入和公共採購日益增長的重要性,所有這些都來自我們的見解和經驗。
約5分鐘
香港醫療儀器本地製造商上市程序:GN-08 指南
本文詳細闡述了香港醫療儀器本地製造商根據醫療儀器行政管理制度 (MDACS) (依循 GN-08 指引) 申請上市的程序。內容涵蓋申請資格、質量管理體系要求以及提交流程,所有這些都基於我們對高效香港醫療儀器製造的見解和經驗。
約5分鐘
香港醫療儀器進口商上市程序:GN-07 指南
對於將醫療儀器進口至香港的實體,醫療儀器行政管理制度 (MDACS) 提供了一項進口商自願上市計劃,依循 GN-07 指引。本文根據我們的見解和經驗,詳細闡述了作為醫療儀器進口商上市的資格、申請步驟和主要要求,以實現高效的香港醫療儀器進口。
約5分鐘
香港醫療儀器分銷商上市程序:GN-09 指南
本文概述了醫療儀器分銷商根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-09 指引) 申請上市的程序。內容涵蓋申請資格、文件化程序的主要要求以及提交流程,旨在加強可追溯性和公共安全,這都是基於我們的見解。
約5分鐘
香港乙、丙、丁類體外診斷醫療儀器上市程序:GN-06 指南
本文詳細闡述了根據香港醫療儀器行政管理制度 (MDACS) (依循 GN-06 指引) 申請將乙、丙、丁類體外診斷醫療儀器 (IVDMDs) 上市的程序。內容涵蓋分類、申請資格、提交要求以及透過MDIS在線申請,所有這些都基於我們對高效香港 IVDMD 上市的見解和經驗。